传统创面治疗手段受限于静态干预模式,创面微环境的监测与修复是分离的,无法实现创面微环境的动态监测与精准调控。为解决这一难题,本实验室贺永教授团队与浙大医学院附属口腔医院俞梦飞研究员团队首次提出 AI融合的再生修复智能闭环系统这一理念,将生物电子技术与人工智能AI结合,实现创面修复过程的监测-分析-干预闭环管理。该系统通过AI解析组织再生过程,动态优化电刺激参数,从而达成修复-调控-再修复的闭环体系。未来的组织再生过程也能像自动驾驶的汽车一样,实时根据创伤状态智能调整治疗方案。该研究以“AI feedback bioelectronics promote infectious wound healing”为题发表在《Cell Biomaterials》期刊。
相较于传统治疗方式,AI融合的再生修复智能闭环系统在应对复杂创面时具有以下三大优势:
(1)首次实现AI与再生型生物电子的深度融合,AI作为组织再生与修复过程的反馈调控核心,提升治疗的智能化水平;
(2)通过对液态金属的智能调控,构建从抗菌防御到组织修复的全程精准干预系统,开创高效、精准的创面治疗新策略;
(3)显著优化创面治疗流程,提升治疗效率,同时降低传统治疗的操作复杂性,实现治疗过程的标准化与智能化。
1. AI生物电子敷料的设计
3D打印是一种能够满足个性化定制需求的制造方法,广泛应用于多个领域。借助其独特的技术优势,我们高效、稳定地制备出一种柔性贴片。简而言之,该水凝胶贴片采用3D打印按需制备,并通过注射器将液态金属(EGaIn)从预留通道注入水凝胶中(三个预留通道可实现Ga³⁺通过水凝胶直接作用于损伤组织)。可以观察到,该方法具有优异的成型性,所得柔性贴片外形规整、质量稳定。此外,为进一步验证该技术的成熟性与稳定性,我们还成功打印出多个复杂图案,包括高校名称缩写(HIT)、五角星及井号符号等。
本研究还系统揭示了Ga³⁺促进皮肤再生的作用机制。为了便于组织缺损的治疗,我们将柔性贴片封装于类似市售胶囊药品的泡罩包装中,便于保存与使用。在组织损伤的早期阶段——创面管理的“黄金时期”,柔性贴片受到高电流刺激,释放出高剂量Ga³⁺,可在短时间内迅速杀灭大量细菌。其抗菌机制如下:细菌体内存在铁载体蛋白,主要负责将外部铁离子(Fe³⁺)转运入细菌体内。在细菌内线粒体产生的NADPH蛋白作用下,Fe³⁺被自动释放和分解,供细菌繁殖所需。然而,铁载体蛋白会错误地将Ga³⁺识别为Fe³⁺并转运入细菌内部。但不同于Fe³⁺,Ga³⁺在NADPH攻击下并不会自动从铁载体中脱离,而是不断在细菌体内积聚,导致其无法获取必要元素,最终破坏细菌膜结构并引发细菌迅速凋亡。在第一阶段利用高剂量Ga³⁺实现抗菌后,研究人员进一步发现,进入第二阶段组织修复过程。低电流刺激下释放的少量Ga³⁺能显著促进细胞迁移。此外,柔性贴片通过低电流刺激可调控巨噬细胞的炎症反应,从而改善免疫微环境(图1a)。最终,这种智能调控机制能够有效加快感染性创面的愈合,促进伤口闭合和组织再生。
进一步地,该柔性贴片集成电子器件,致力于实现治疗与监测的动态交互,借助机器学习技术为智能创面愈合提供先进解决方案。在器件设计方面,该生物电子系统包含蓝牙模块、电流控制单元及处理器等核心组件。蓝牙模块可实现远程数据传输与交互,电流控制单元精准调控高低电流以实现Ga³⁺释放的可控性,处理器则负责数据处理与反馈调节(图1b)。图1c展示了AI反馈生物电子系统的逻辑工作流程。用户通过控制界面输入伤口信息,系统接收并处理伤口图像。核心结构采用水凝胶封装液态金属的柔性设计,不仅具备优异的机械柔韧性与生物相容性,还能实现Ga³⁺释放的稳定性与可调节性,适应复杂的生物组织环境,满足临床应用需求。
进一步的,研究人员借助机器学习算法构建高效的神经网络模型,实现对伤口愈合过程的动态监测与预测。系统通过收集和分析伤口图像,将其输入神经网络模型的输入层,隐藏层与Dropout层则进行特征提取与模型训练,最终实现愈合状态的精准评估与预测输出。若模型判断伤口未达到预期愈合效果,系统会立即识别异常并通过动态调整治疗参数进行干预(图1d)。AI模块基于图像预测伤口状态,并据此决定治疗方案—如选择高电流模式以达到抗菌目的,或采用低电流模式以促进组织再生。根据系统决策,自动选择相应电流强度并释放合适剂量的Ga³⁺。治疗结束后,再次采集伤口图像并输入系统,形成闭环反馈机制以优化治疗效果。通过动态决策与调整,实现了个性化的闭环式智能伤口管理。
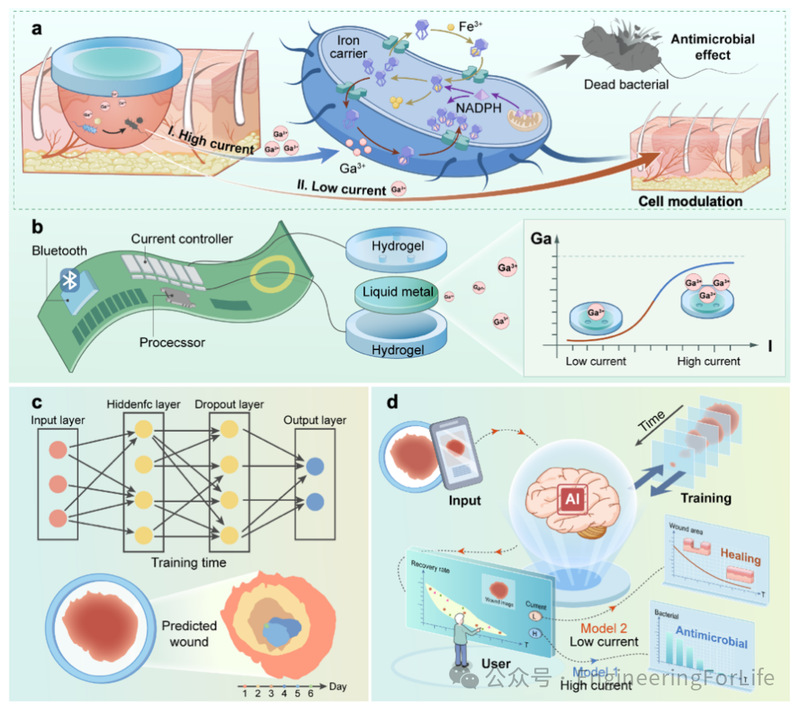
图 1 AI再生生物电子的设计
2. 水凝胶的合成与表征
水凝胶的合成基于团队前期的研究,并在此基础上引入了单宁酸(Tannic acid, TA)以优化复合水凝胶的性能。我们对不同浓度TA的复合水凝胶进行了扫描电子显微镜(SEM)表征(图2a)。可以观察到,随着TA含量的增加,复合水凝胶的孔隙率逐渐降低,这意味着对Ga³⁺自由迁移的阻力增强(图2b)。在此基础上,我们进一步研究了复合水凝胶的力学性能。结果显示,随着TA含量的增加,拉伸模量和黏附强度均有明显提升(图2c-d)。同时,复合水凝胶具有出色的形状适应性,能够紧密贴附于多种复杂形状的表面。这一性能有效弥补了普通水凝胶在伤口渗出液作用下粘附性能差的缺陷。
此外,我们还深入探讨了TA增强复合水凝胶力学性能的作用机制。随着TA浓度的增加,复合水凝胶的储能模量(G')与损耗模量(G'')均呈上升趋势,表明TA的引入使水凝胶的抗应力能力增强,弹性提升。在受力过程中,水凝胶能够迅速耗散能量,同时表现出更高的黏弹特性(图2e-f)。我们还通过差示扫描量热法(DSC)在分子结合层面揭示了TA增强作用的机制。随着TA含量的增加,复合水凝胶的熔融峰升高,说明其内部分子之间的结合力增强,材料稳定性更高(图2g)。该结果进一步通过傅里叶变换红外光谱(FTIR)验证,结果显示随着TA含量的提高,酚羟基官能团的峰强度逐渐增强。
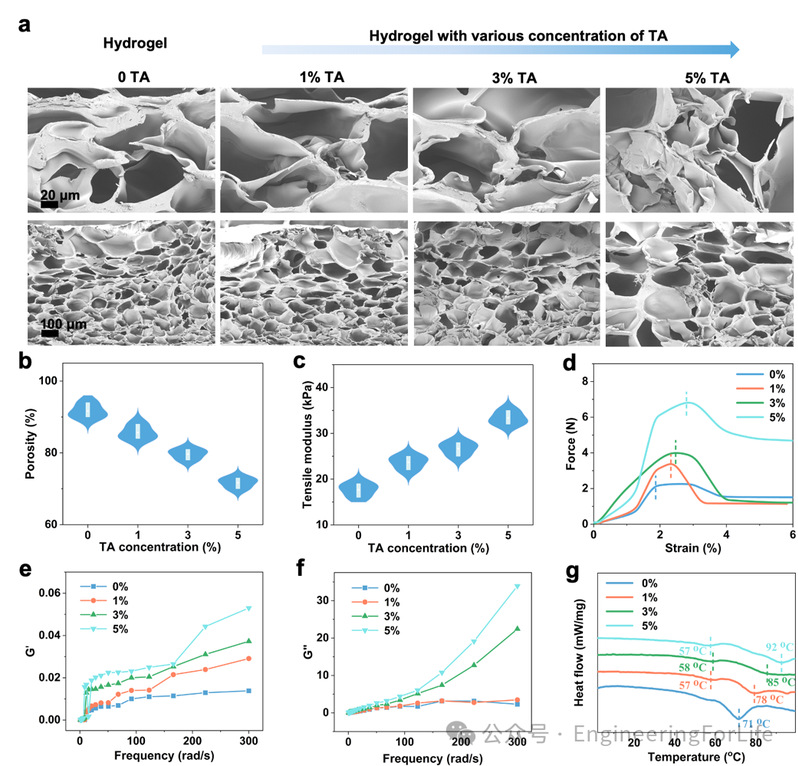
图 2 水凝胶的机械性能
3. 体外抗菌性能
为验证柔性生物电子贴片优异的抗菌性能,我们采用多种方法开展了体外抗菌实验(图3,所有实验组的水凝胶中均含有微量单宁酸 TA)。由于金黄色葡萄球菌(Staphylococcus aureus, S. aureus)和大肠杆菌(Escherichia coli, E. coli)是创伤感染中最常见的致病菌,因此选取它们作为细菌模型。为了证明微量TA不具备抗菌性能,我们首先进行了验证实验。在低含量条件下,TA对细菌没有明显的破坏作用。图3a和3d显示,纯水凝胶组以及低电流刺激的贴片组均未表现出明显的杀菌效果。然而,当电流强度达到4 mA时,几乎所有细菌都被杀灭。此外,荧光显微镜图像显示,在Blank组、水凝胶组、水凝胶+EGaIn组、水凝胶+EGaIn+电流1mA组、水凝胶+EGaIn+电流2mA组中,细菌形成了致密的生物膜(图3b)。
为了排除电流本身对细菌活性的干扰,我们对不含任何抗菌成分的原始水凝胶进行了电刺激。结果明确表明,仅靠电流并不能抑制细菌生长。然而,当柔性贴片施加4 mA电流刺激后,观察到荧光图像中绿色信号稀疏,说明细菌被杀灭,生物膜结构呈碎片化状态。进一步通过对细菌三维生物膜厚度的定量分析验证发现,4 mA电流刺激下的柔性贴片展现出优异的抗生物膜能力(图3e)。此外,采用扫描电子显微镜(SEM)观察细菌形貌,如图3c所示,在水凝胶+EGaIn+电流4 mA组中,细菌形态严重变形、扭曲。上述所有实验结果均与Ga³⁺的释放曲线一致。
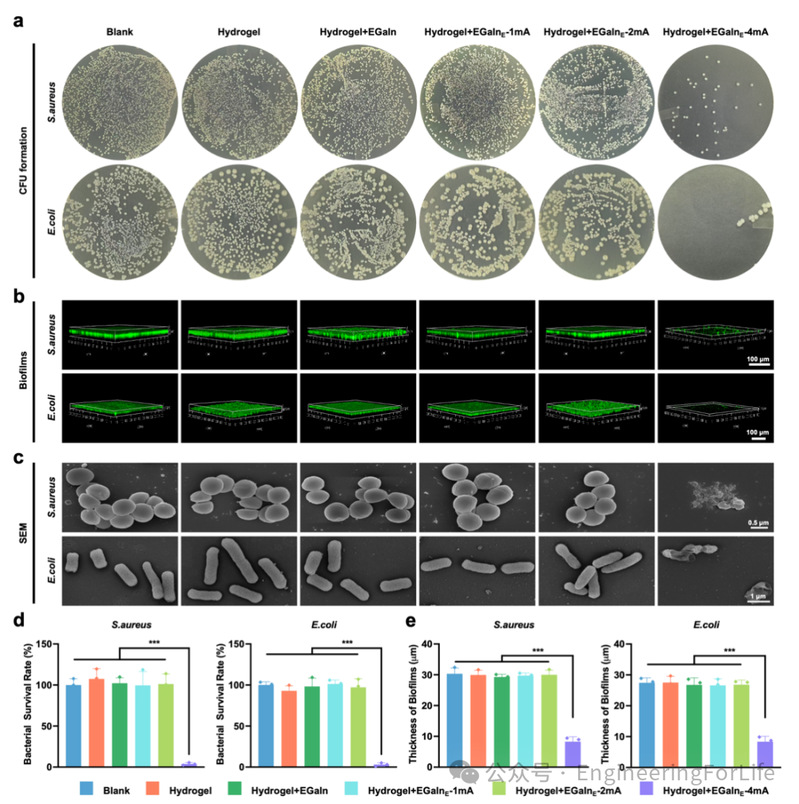
图 3 柔性贴片的抗菌性能
4. 体外抗菌机理
液态金属在抗菌方面的应用研究已有大量报道,但其抗菌作用机制尚不清晰,这在很大程度上限制了液态金属抗菌产品的实际应用。为解决液态金属抗菌机制尚不明确这一关键难题,我们开展了深入研究,并提供了详实的实验证据。首先,我们利用电化学工作站对液态金属的氧化还原行为进行了表征。实验结果表明,随着交流扫描速率的增加,液态金属的氧化能力逐渐减弱,而还原能力增强(图4a)。这说明,液态金属中由于氧化作用形成的氧化镓膜可以被电化学刻蚀完全去除,从而释放出Ga³⁺(图4b)。随后,我们通过高分辨透射电子显微镜(TEM)观察液态金属在交流电流作用下释放Ga³⁺的过程。实验发现,在交流电作用下,液态金属表面迅速形成氧化膜,并随即剥落。该过程不断循环,最终在液态金属球体周围形成絮状的无定形结构。当该结构进一步受到电流刺激时,会转变为单晶Ga₂O₃球形结构。这种球形结构具有较大的比表面积,有利于其与PBS中的OH⁻离子接触,最终生成Ga³⁺。为确定最佳电流强度,我们对液态金属施加了不同电流,分析其对Ga³⁺释放的影响。结果表明,电流强度的提升促进了单晶球体的生成,从而为Ga³⁺的释放提供了保障。但当电流过高时,生成产物骤然增多,且刻蚀效果并不明显(图4c)。
为验证Ga³⁺的抗菌机制,我们运用第一性原理对实验现象进行了理论解释。在正常存活过程中,金黄色葡萄球菌(S. aureus)和大肠杆菌(E. coli)会释放铁载体蛋白。这些蛋白通过末端的-C=O基团与Fe³⁺配位,形成(-C-O)-Fe结构,经由特异性蛋白通道进入细菌体内,提供细菌生长所需的铁元素。然而,Ga³⁺与Fe³⁺性质相似,也能与铁载体蛋白配位形成(-C-O)-Ga结构,并被糖蛋白识别后进入细菌。进入细菌后,线粒体释放携带电子的NADPH蛋白,这些蛋白攻击(-C-O)-Fe结构,分解其为-C=O,并释放Fe³⁺,供细菌继续合成必需物质。但当形成的是(-C-O)-Ga结构时,NADPH蛋白无法分解O-Ga键,使得铁载体蛋白失效,细菌无法获得生存所需元素,最终导致渗透失衡,细菌死亡(图4d)。
通过TEM,我们进一步研究了铁载体蛋白与液态金属的原子结构。图像中可清晰观察到液态金属的晶体特征,晶格间距约为2.11 Å。而令人振奋的是,在加入铁载体蛋白后,整体结晶性显著增强,晶格间距扩大至约2.67 Å,这一变化体现了铁载体蛋白与液态金属之间的协同作用(图4e)。通过HRTEM分析,我们还证实了Ga掺杂颗粒在被吞噬的大肠杆菌内的形成,并在颗粒表面观察到由肽类铁载体来源的氮元素富集现象。
为进一步证明(-C-O)-Ga结构对NADPH蛋白的免疫抗性,我们从配位与还原的量子力学角度出发,计算了其反应原理。首先,该过程满足哈密顿算符(Hamiltonian operator):
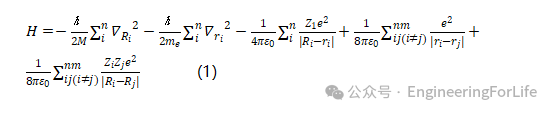
其中,h为普朗克常数,me为电子质量,∇Ri为原子坐标梯度,ε₀为空间介电常数,Zi为离子携带的电子数,Ri为第i个离子的坐标,ri、rj为第i、j个电子的坐标,e为基本电荷。
简化后得出:
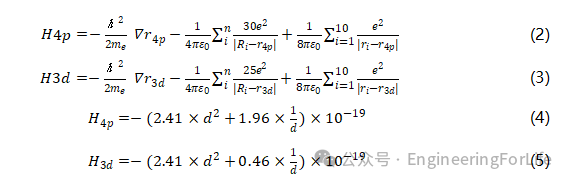
其中,D3d < D4p,经计算发现,电子在该点的能量为 -1.9×10⁻¹⁹ J,足以轰击(-C-O)-Fe结构实现还原,但对于(-C-O)-Ga结构,其能量远高于 -1.9×10⁻¹⁹ J,使得NADPH蛋白无法将其还原。这正是Ga³⁺产生抗菌效应的根本机制所在。
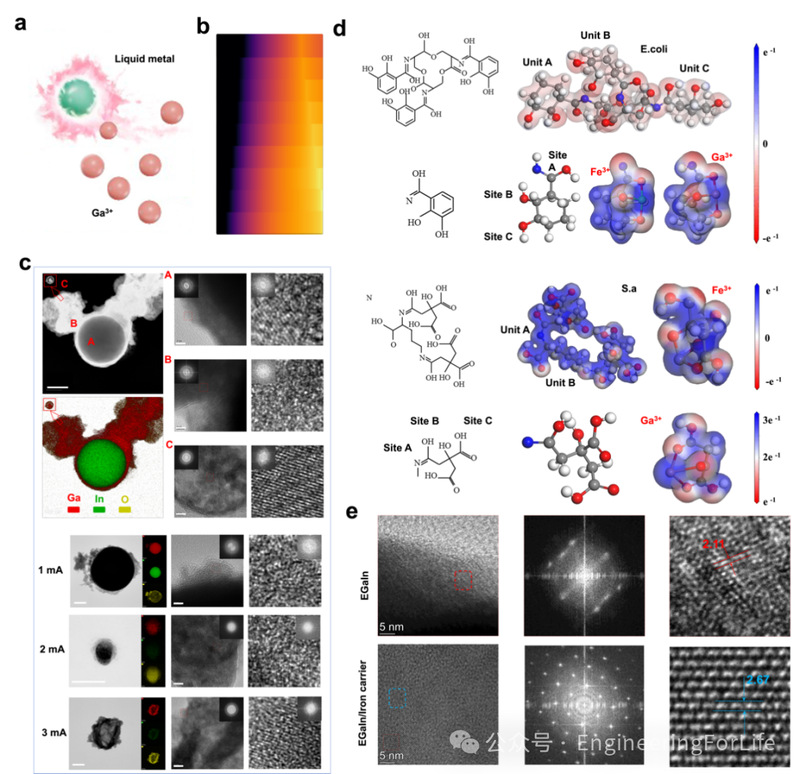
图 4 抗菌机理
5. 体外细胞迁移
实际应用中,不仅需要具备优异的抗菌性能,还必须具有良好的生物相容性。我们在体外使用与伤口愈合密切相关的两种细胞—人角质形成细胞(HACAT)和人静脉内皮细胞(HUVEC)—对该系统的生物相容性进行了评估。结果显示,当细胞与纯水凝胶或低电流刺激的柔性贴片共培养时,细胞仍能维持良好的活力。然而,在使用4 mA电流刺激柔性贴片时,细胞增殖能力受到抑制,说明Ga³⁺的高释放量对细胞产生了一定的副作用(图 5a)。因此,本工作的核心策略是在感染早期通过高电流刺激快速消灭大量细菌,随后在愈合后期施加低电流刺激以促进细胞增殖。
细胞迁移是推动伤口愈合的基础步骤。研究发现,在低电流条件下,柔性贴片能够促进HACAT和HUVEC的迁移。尤其是在施加2 mA电流刺激的条件下,细胞的相对迁移面积达到了Blank组的1.5倍(图5b)。如图5c所示,在Hydrogel+EGaInE-2mA组中,48小时后两侧的细胞几乎完全融合,表明细胞迁移效率显著提升。持续性的炎症反应会对组织再生产生不利影响。我们进一步利用巨噬细胞评估柔性贴片对炎症反应的调节作用,因为巨噬细胞在伤口愈合过程中发挥着关键作用。如图5d所示,在LPS刺激下,巨噬细胞表达的促炎相关基因(iNOS、TNF-α 和 IL-6)显著上调,而在低电流刺激的柔性贴片作用下,促炎反应被明显抑制。此外,在与IL-4共培养条件下,低电流刺激的柔性贴片还能显著提高巨噬细胞中抗炎相关基因(Arg-1、TGF-β 和 IL-10)的表达。更重要的是,在Hydrogel+EGaInE-2mA组中,这种免疫调节能力表现最为显著。综上所述,通过选择性地调控电流强度以适应不同阶段的修复需求,柔性贴片在伤口愈合过程中不仅实现了良好的生物相容性,还具备出色的细胞调节功能,具有广阔的临床应用前景。
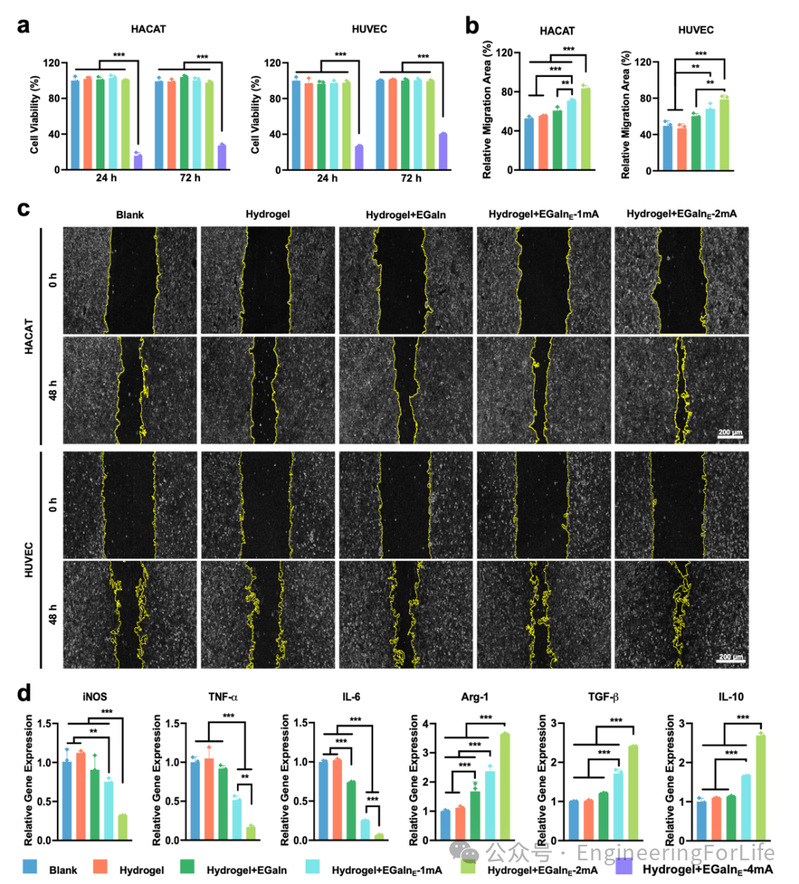
图5 细胞迁移影响
6. 创面愈合
基于其在体外实验中的卓越表现,研究者将智能生物电子敷料应用于小鼠感染性创伤模型的背部,以评估其在促进创伤愈合方面的效果(图6)。在为期14天的观察期内,通过数码照片对创面愈合情况进行了跟踪记录(图6a-c)。结果显示,经过14天治疗,Hydrogel+EGaInE组的创口几乎完全闭合,而其他组仍存在不同程度的创口缺损。定量分析显示,治疗3天后,Blank、Hydrogel、Hydrogel+EGaIn 和 Hydrogel+EGaInE组的创口闭合率分别为22.0%、22.6%、23.6%和31.3%。此外,Hydrogel+EGaInE组在整个愈合过程中始终表现出更快的愈合速率。至第14天,该组的创口闭合率达到95.8%,显著高于其他组(P<0.05)。
H&E染色结果表明,Blank、Hydrogel和Hydrogel+EGaIn组的创口中均存在大量免疫细胞浸润,而施加电刺激处理的贴片组则显著减少了免疫细胞的沉积。Masson染色结果显示,Hydrogel+EGaInE组的胶原纤维密度最高,且显著高于其他组(P<0.05)(图6f和6g)。创口的血管新生通过CD31免疫荧光(IF)染色进行评估。结果显示,在电流调控下处理的创口表现出大量CD31阳性血管,提示电刺激可促进创口的血管生成,从而为组织再生提供氧气和营养支持。感染性创面通常表现为持续性炎症,因此在止血后有效应对炎症期是促进创伤愈合的关键策略之一。Hydrogel+EGaInE组中促炎因子(iNOS和IL-6)水平显著降低,而抗炎因子(Arg-1和IL-10)水平显著升高,优于其他组。
总体而言,通过对创伤愈合过程的14天跟踪结果可见,给予柔性贴片可控电刺激的治疗手段在促进伤口愈合方面显著优于其他对照组。这种治疗效果可归因于以下几个协同机制:(1) 水凝胶可吸收多余的渗出液和血清,促进皮肤呼吸,有助于创伤修复;(2)在高电流刺激下,产生较高浓度的Ga³⁺。尽管高浓度Ga³⁺在体外会抑制正常细胞活性,但感染部位的细菌增殖速度远快于正常细胞,因而更快更大量地吸收并利用Ga³⁺。Ga³⁺被细菌误识为Fe³⁺从而被摄入,导致代谢错误并引发细菌死亡;(3)在低电流刺激下,产生较低浓度的Ga³⁺,此时能够促进细胞迁移、抑制炎症,最终加速创伤愈合进程。
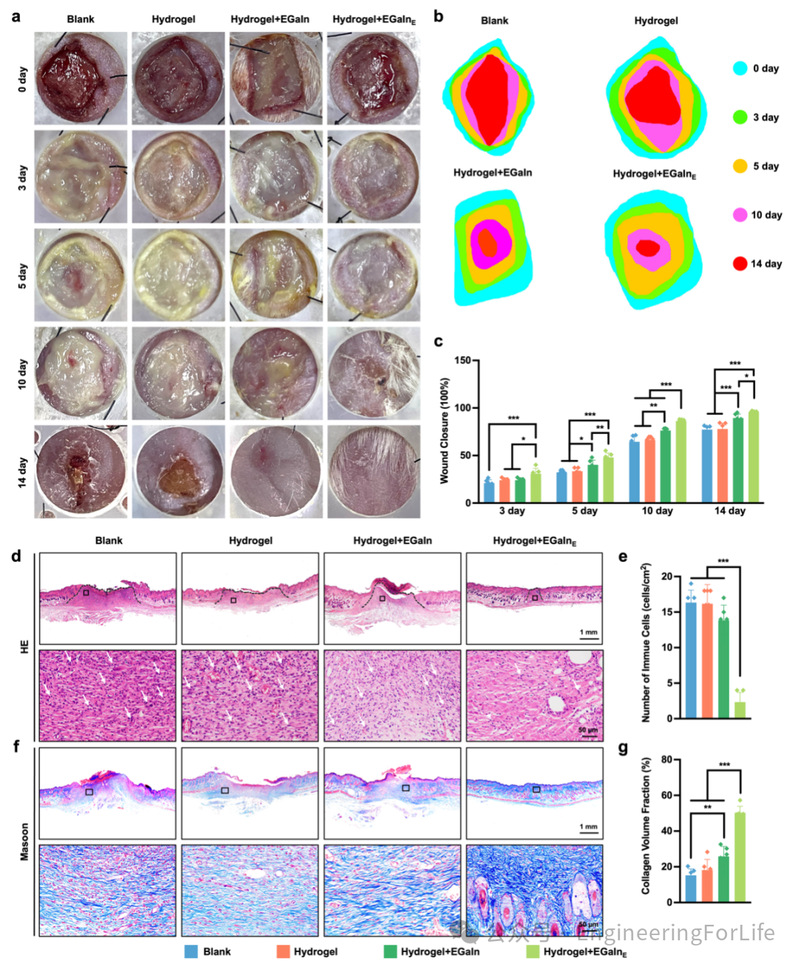
图 6体内创面愈合性能
7. AI辅助治疗
此外,本研究全面展示了人工智能在伤口愈合监测与管理中的应用,整合了机器学习、标准化愈合模型以及动态监测与干预功能(图7)。对于感染性伤口,传统治疗方法依赖有经验的医生定期进行清创和换药,这种方式依靠医生的主观判断,对患者而言不够便捷。
该人工智能系统采用深度学习算法,特别是多尺度注意力模块(MSA),实现了高效的图像识别和伤口愈合过程预测(图7a-c)。首先,输入层通过摄像设备获取高分辨率的伤口图像,并将图像数据传入网络。网络通过多个卷积层提取特征,获取伤口图像的局部和全局特征,包括愈合过程中形态变化和面积变化等。基于这些特征,MSA模块能够有效关注图像中最关键的区域,尤其是伤口边缘和正在发生显著变化的部位。通过对这些关键特征加权处理,MSA显著提升了模型的预测准确性。网络随后通过特征图处理模块对提取的信息进行分层处理,实现更精细的伤口变化识别与分析。最终,网络生成预测性的伤口愈合特征图,直观展示伤口愈合过程中如面积变化、愈合分布等具体信息,便于理解和监测。
此外,通过结合卷积与上采样操作,网络不仅提取了局部细节信息,还捕捉到了伤口愈合过程中长期和大尺度的变化趋势,从而提供了在不同时间点的全面愈合图景。借助这些技术,该AI系统能够精准分析伤口的大小、形态及其随时间演变的变化情况,为后续的治疗决策提供数据支持。这种高精度分析方法确保了伤口愈合过程的实时监测与预测,为制定个性化治疗方案提供了科学依据。系统通过追踪伤口在各个时间点的恢复情况,生成愈合曲线,量化伤口愈合速率和趋势,建立标准化的伤口愈合模型。该模型可作为参考基准,将实际愈合数据进行比对,识别异常愈合情况,从而为后续治疗提供精确的反馈支持。在模型训练过程中,包括mIoU(平均交并比)、mPA(平均像素准确率)以及总体准确率等关键性能指标,随着训练迭代次数的增加呈现逐步提升的趋势(图7d)。随着模型不断优化,其提取语义特征的能力逐渐增强,整体性能稳步提高。特别是在训练初期,性能指标展现出明显的上升曲线,表明模型能够快速学习基础特征信息。在进入解冻训练阶段后,由于引入更多可训练参数及网络结构调整,所有指标出现了轻微波动。这种波动是模型适应更大搜索空间过程中正常的现象。总体而言,尽管存在一定起伏,三项指标在后期均保持良好的增长趋势并趋于稳定,说明模型已基本收敛,具备良好的稳健性与泛化能力(图7e)。通过模型训练,系统建立了标准化愈合数据,并具备与参考曲线进行对比的功能(图7f)。若AI系统检测到愈合进程未按预期推进,即可立即触发干预机制,调整治疗参数和策略,确保愈合效果的精准优化。
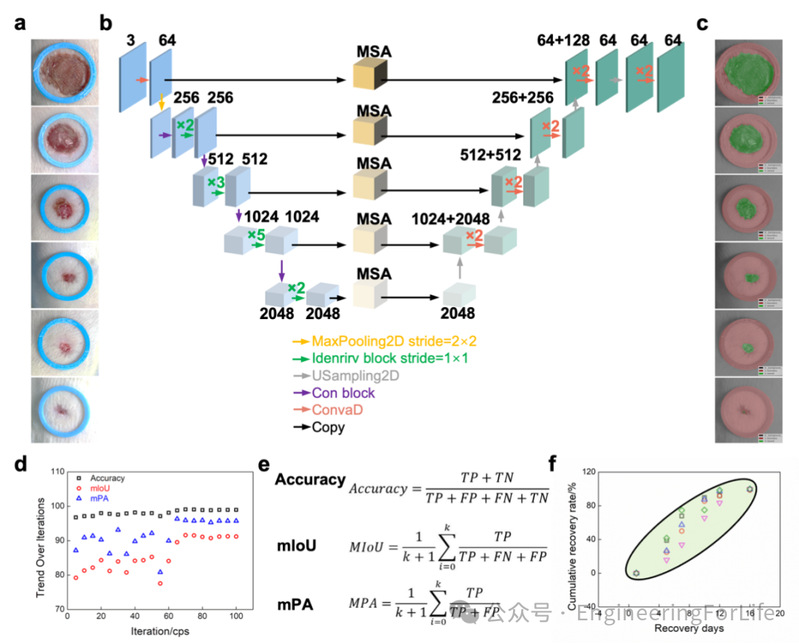
图 7 AI系统
8. AI生物电子产品
此外,本研究所制备的智能生物电子敷料具有制备步骤简单、易于规模化生产的优点(图8)。利用光固化3D打印技术,可实现水凝胶基底的阵列式批量打印,随后添加液态金属,简单组装后即可形成产品(图8a)。通过压缩测试对该一体化系统的力学性能进行评估。器件经历了10,000次最大应变为50%的单轴往复压缩测试,表现出优异的抗疲劳性能。
研究人员还进一步构建了智能生物电子系统,包含直流-交流转换模块、无线电位器、温度传感器及供电系统(图8b)。其中,直流-交流转换模块将直流电转化为交流电,能够有效避免水的电解对器件电路造成影响;无线电位器根据专家系统指令动态调节电路输出电流;温度传感器作为图像系统的补充,用于检测伤口温度,当图像系统识别出愈合缓慢时判断是否发生感染。
如图8c-d所示,第0、2和3天分别定义为细菌感染阶段(BIS)、恢复阶段(RS)和抗菌治疗阶段(AS)。第0天建立感染性伤口模型后,在1–2天内形成细菌感染,3–4天期间进行治疗。在此过程中,用户通过图像采集设备与AI系统交互,AI系统调节施加在生物电子上的刺激电流,在AS阶段实现对感染伤口的精准调控治疗。在三种不同条件下评估伤口愈合情况:无调控、延迟调控与即时调控(图8e-g)。在感染阶段,伤口愈合率呈负值,反映出伤口恶化趋势。感染控制后,用户通过手机拍摄伤口图像上传至AI系统,系统评估伤情并调整输出电流,实现个性化治疗。结果表明,AI反馈式生物电子系统在促进伤口愈合方面表现出优异效果。采用标准组织学评估方法,我们对动物治疗后主要器官(心、肝、脾、肺、肾)进行了全面分析。结果未发现明显的炎性细胞浸润、组织水肿或其他病理改变,所有组织均保持结构完整(图S21)。这些结果表明该治疗方案具有良好的生物安全性。
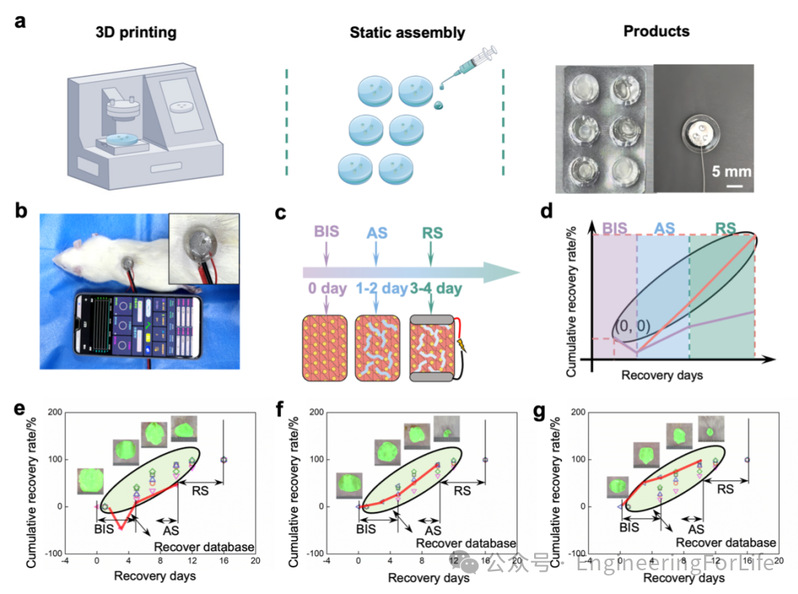
图 8 应用展示

