内耳感觉上皮由感觉毛细胞和非感觉支持细胞所构成,声音的感受以及声-电信息转换由内耳感觉上皮的毛细胞所完成。感觉上皮的完整性对于听觉功能感知极为重要,哺乳动物的毛细胞一旦受损,难以自发性再生,因此明确感觉上皮的发生和维持的机制对听觉功能重建策略的制定极为重要。目前发育生物学集中在研究内耳前体细胞本身的内部基因特化为感觉上皮,然而,驱使内耳前体细胞转变为感觉上皮细胞的源动力未知。
近期,复旦大学附属眼耳鼻喉科医院李文妍教授、李华伟教授团队和浙江大学贺永教授团队合作,在Science子刊《Science Advances》期刊发表题为“Varying Mechanical Forces Drive Sensory Epithelium Formation”的研究论文,该项研究破解了内耳感觉上皮发生源动力的这一谜团。该研究通过建立力学性能可控的水凝胶体系培育内耳类器官,揭示了细胞外基质(ECM)的力学梯度变化为促发内耳感觉上皮发生的动力,并分别解析了不同硬度引发内耳前体细胞扩增及分化的信号调控分子机制,为感音神经性耳聋的再生治疗提供了新线索。
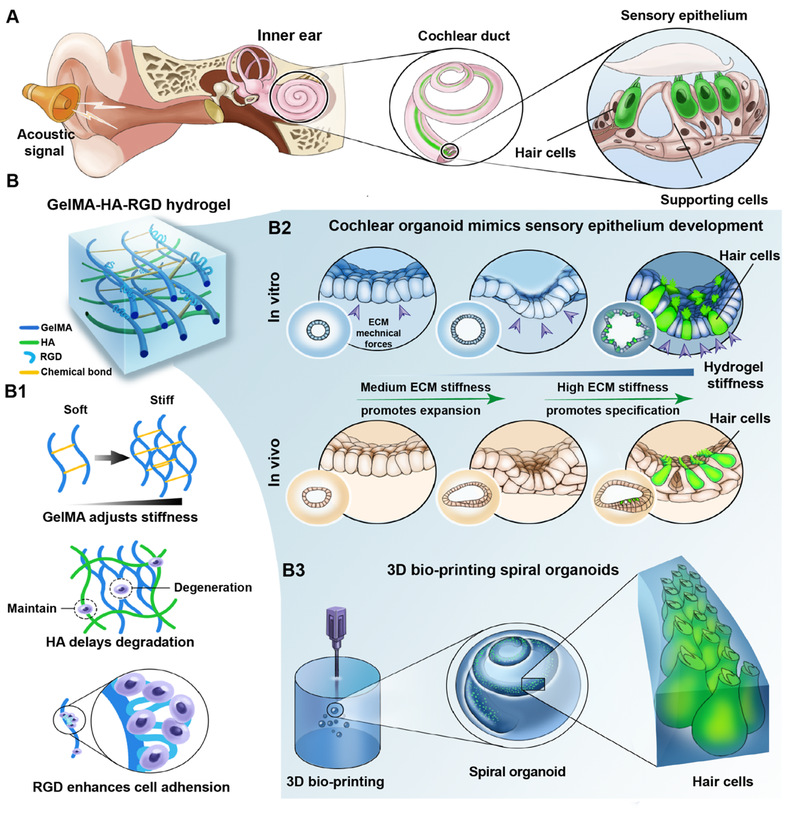
图1 机械性能可控的水凝胶体系调控内耳类器官形成机制
1. 建立机械应力可控的复合水凝胶体系
研究团队结合既往研究基础,假设ECM挤压为推动感觉上皮发生的动力,结合类器官研究发育的巨大优势,制备机械应力可控的复合水凝胶体系,通过改变水凝胶的机械参数研究内耳类器官的生物学特性。为高效调控类器官培养过程中的机械应力,团队开发了由GelMA(EFL光固化GelMA水凝胶产品介绍)、HA及RDG(EFL丙烯酰化RGD肽产品介绍)三种组分构成的类器官培养用复合水凝胶。其中光固化的GelMA水凝胶,是明胶和甲基丙烯酸酐交联合成,其具备生物兼容性优越,理化属性稳定可控的特点。HA作为一种天然存在于生物体内的糖胺聚糖,可进一步提高凝胶基质稳定性和亲水性。同时RDG为作为细胞粘附的功能基团,增加水凝胶的生物兼容性。通过明确水凝胶功能成分不同浓度对类器官细胞活性影响,划定各成分范围。探索了各个成分不同浓度对水凝胶硬度、吸水性能、孔径等影响,以GelMA浓度作为水凝胶机械应力调控的参数。
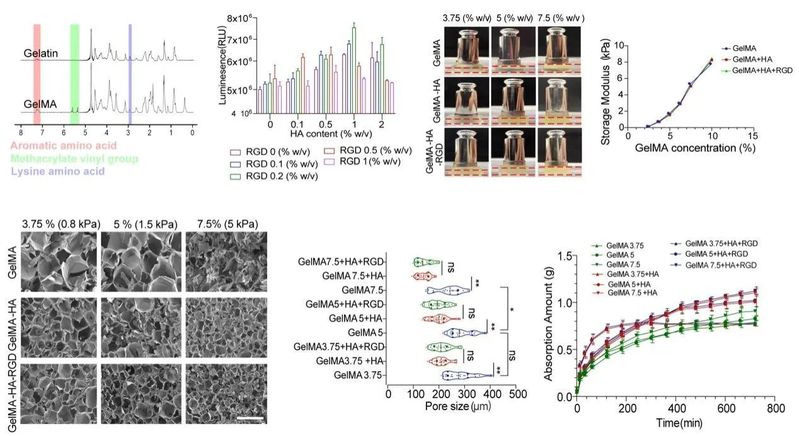
图2 复合水凝胶机械性能及表征
2. 水凝胶硬度调控内耳类器官形成
为探索ECM对内耳前体细胞命运影响,团队通过改变水凝胶机械参数,培育内耳前体细胞来源类器官。随着水凝胶的硬度增加,1.5kPa条件的水凝胶硬度能够最佳的促进类器官细胞的增殖,与Matrigel中培养相当。继续增加水凝胶的硬度会导致细胞增殖能力的减退,包括前体细胞标志物Lgr5的表达。将1.5kPa水凝胶中培育的类器官分别种植于不同硬度水凝胶继续培养半个月后,发现类器官细胞细胞分化为毛细胞的效率在0.2-5kPa呈现逐渐增加,继续增加硬度会使毛细胞的分化效率下降。因此,内耳前体细胞的命运受ECM的硬度所调控。5kPa复合水凝胶中的类器官毛细胞比例高于Matrigel中培养的比例,可控水凝胶体系可更好的诱导内耳类器官的形成。
将复合水凝胶体系培育的内耳类器官发育过程与体内感觉上皮发育过程进行类比,发现多个关键标志物呈现相同的表达趋势,证实了水凝胶中类器官可以高度模拟感觉上皮的生物学特性。原子力显微镜检测发育过程中的上皮紧靠的间质细胞(主要ECM分泌细胞)区域,发现细胞特化的关键时间点,该区域硬度处于最好水平,进一步说明ECM硬度调控内耳感觉上皮形成。
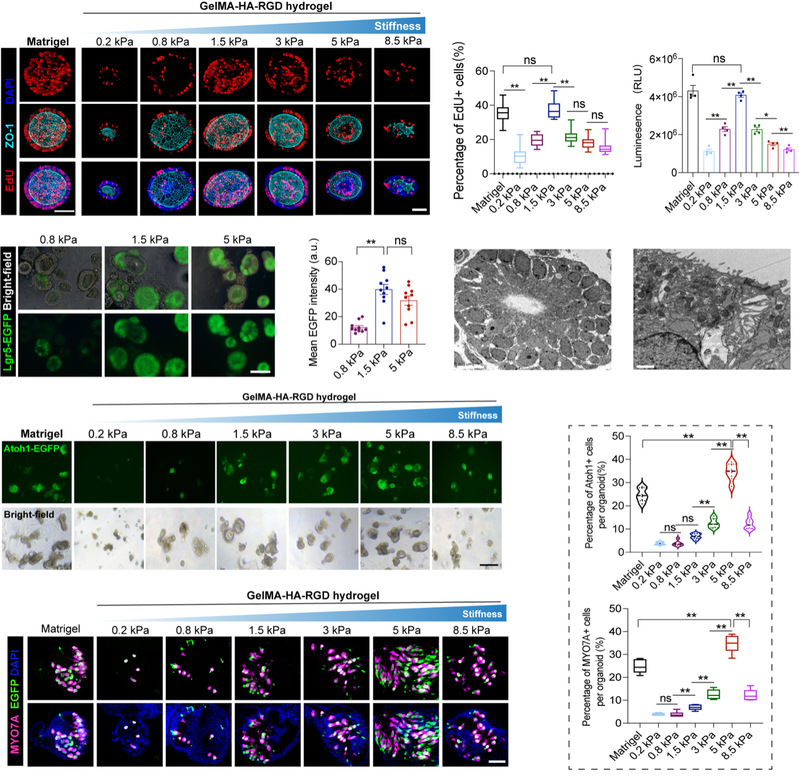
图3 水凝胶硬度调控类器官细胞扩增和分化
3. 解析ECM硬度调控感觉上皮发生机制
通过对发育规律的解析,可解析相关调控细胞命运的关键靶点。对中等硬度(1.5kPa)促细胞增殖机制进行解析,干预YAP,F-actin等靶点发现其传导中等ECM的作用。并明确中度的细胞外基质硬度通过细胞表面的ITGA3感知,继而细胞内F-actin骨架重聚,诱发YAP核转位来驱动前体细胞的增殖。
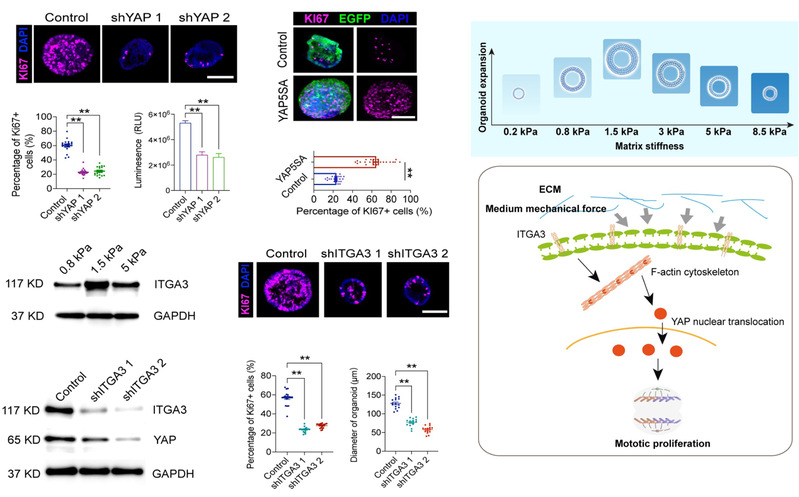
图4 ECM中等硬度调控内耳前体细胞扩增的机制
Bulk-RNAseq对比中等硬度(1.5kPa)和高硬度(5kPa)水凝胶当中的类器官基因组学特征,找到相关关键差异基因及富集信号。通过相关小分子化合物抑制剂和基因联合干预,揭示较高的细胞外基质硬度促发感觉上皮的特化则需要细胞表面的机械感受分子PIEZO2的活化,使得钙离子内流,驱使细胞内ERK去磷酸化,活化转录因子KLF2来驱动细胞命运转变,实现前体细胞分化为毛细胞和支持细胞。ECM梯度硬度变化促发内耳前体细胞扩增和分化的机制得到解析,为感音神经性耳聋的再生治疗提供了关键的靶点。
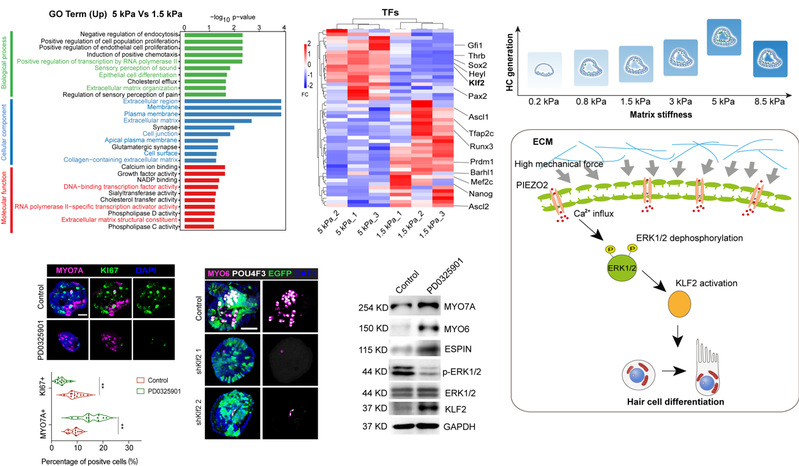
图5 ECM高硬度调控内耳前体细胞分化的机制
4. 结构化类器官:3D打印下一代内耳类器官
团队利用复合水凝胶的可操控性,结合3D打印技术,打印内耳类器官细胞,构建了具备螺旋状的上皮形态,高度类似于体内的内耳感觉上皮形态。这一形态颠覆了既往内耳类器官的囊状结构,使得内耳类器官有望能从无序发育迈向结构化调控。
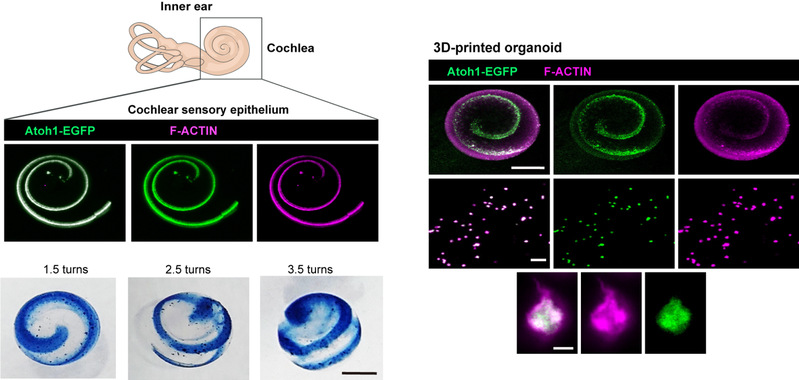
图6 3D打印内耳感觉上皮结构化螺旋状类器官
复旦大学附属眼耳鼻喉科医院夏明宇、吴明轩及浙江大学机械工程学院李元戎为该研究共同第一作者,李文妍教授、李华伟教授和贺永教授为共同通讯作者。此项研究工作的参与者还有:刘耀谦、马艽遥、楼伊云、贾高干、高庆等。本研究由科技部“干细胞及转化研究”国家重点研发计划、国家自然科学重大专项和上海市科委项目等多项基金的资助。
文章来源:
https://www.science.org/doi/10.1126/sciadv.adf2664

